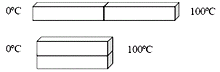
Termodinámica 7. Una varilla de cobre y otra de acero de igual
longitud y sección transversal están soldadas con un extremo en común. El
extremo libre de la varilla de cobre se mantiene a 100°C y el extremo libre de
la de acero, a 0°C. Las varillas están aisladas lateralmente. El coeficiente de
conductividad térmica del cobre es 8 veces el del acero. Una vez que alcanza el
régimen estacionario, podemos afirmar que:
a) la
temperatura de la unión de ambas varillas es menor que 50°C.
Falso
Ley de Fourier:
Q/Δt = -k A ΔT / Δx
donde
Q/Δt = flujo de calor
k = constante de conductividad térmica (kcu = 8 kac)
A = área de la barra (igual para ambas barras)
ΔT = variación de la temperatura = (T2 – T1)
Δx = longitud de la barra (igual para ambas barras)
Régimen estacionario Q/Δt = constante
Varilla de cobre ---------- > Q/Δt = -kcu A (Tu – 100ºC) / Δx
Varilla de acero ---------- > Q/Δt = -kac A (0ºC – Tu) / Δx
Reemplazando e igualando
- 8 kac A (Tu – 100ºC) / Δx = - kac A (0ºC - Tu) / Δx
8 (Tu – 100ºC) = (0ºC - Tu)
Despejando Tu
Tu = (0ºC + 800ºC) / (8 + 1) = 800ºC /9 = 89 ºC < ----------- temperatura de la unión
Tu =
89ºC < 50ºC
█ b) la
temperatura de la unión de ambas varillas es mayor que 50°C.
Verdadero
Ver ítem a) ------------- > Tu = 89ºC
> 50ºC
c) las
diferencias de temperatura entre los extremos de ambas varillas son iguales.
Falso
Varilla de cobre ---------- > - (89ºC – 100ºC) = 11ºC
Varilla de acero ---------- > - (0ºC – 89ºC) = 89ºC
----------
> ΔTcu = 11ºC ≠ 89ºC = ΔTac
d) la
cantidad de calor que, por unidad de tiempo, atraviesa cualquier sección
transversal de la varilla de cobre es mayor que la que atraviesa cualquier
sección transversal de la varilla de acero.
Falso
Régimen estacionario Q/Δt = constante------
> Qcu/ Δt = Qac/ Δt
e) la cantidad de calor que, por
unidad de tiempo, atraviesa cualquier sección transversal de la varilla de
cobre es menor que la que atraviesa cualquier sección transversal de la varilla
de acero.
Falso
Régimen estacionario Q/Δt = constante -------
> Qcu/ Δt = Qac/ Δt
f) no fluye calor a través de las
varillas.
Falso
ΔTcu ≠ 0ºC y ΔTac
≠ 0ºC ---------- > Q/ Δt ≠
0